Datazione radiometrica
Tra le conseguenze più importanti della scoperta della radioattività va annoverato il
fatto che su questo fenomeno si basa un metodo effettivamente attendibile per la
determinazione dell’età di rocce e minerali contenenti isotopi radioattivi: la datazione
radiometrica. L’attendibilità di tale metodo è dovuta al fatto che la
velocità di decadimento di un isotopo radioattivo è costante e indipendente da
qualsiasi fattore fisico o chimico.
Il tempo di dimezzamento
ha un valore caratteristico per ogni isotopo radioattivo e ne esprime la velocità di
disintegrazione. Ad esempio, se partiamo da un grammo di isotopo radioattivo, dopo che
sarà trascorso un tempo pari al suo tempo di dimezzamento resterà di quell’isotopo
solo mezzo grammo; di questo mezzo grammo la metà (ossia un quarto di grammo) sarà
decaduta dopo che sarà trascorso un altro tempo pari al tempo di dimezzamento, e così
via.

Fig. 1
Decadimento di un ipotetico isotopo radioattivo |
La figura 1 illustra il
principio della datazione radiometrica nel caso di un campione di roccia contenente un
ipotetico isotopo radioattivo che, con tempo di dimezzamento di 1 milione di anni, decade
direttamente in un isotopo stabile. Determinando con opportune analisi la percentuale di
un isotopo radioattivo ancora presente e quella di isotopo stabile già prodotto, si può
risalire all’età del campione in esame. Ad esempio, se risulta che i due isotopi
sono presenti in uguale quantità (cioè in rapporto 1:1), se ne deduce che è trascorso
esattamente un tempo pari al tempo di dimezzamento e che, quindi, il campione di roccia ha
un milione di anni; se invece si trova un rapporto tra isotopo radioattivo e isotopo
stabile di 1:15, se ne deduce che il campione di roccia ha circa 4 milioni di anni. Dei
numerosi isotopi radioattivi esistenti in natura, solo i cinque riportati nella tabella
seguente si presentano particolarmente bene per la datazione radiometrica di alcune rocce.
Quanto infatti agli altri isotopi radioattivi, o sono presenti in quantità troppo
piccole, o hanno tempi di dimezzamento troppo brevi o troppo lunghi per essere
effettivamente utili.
Ci si basa in genere sul rubidio-87 e sui due isotopi dell’uranio (235 e 238) solo
per datare rocce vecchie di milioni di anni. Il potassio-40 ha invece un campo di impiego
più vasto; infatti, anche se il suo tempo di dimezzamento è piuttosto elevato (1.3
miliardi di anni), recenti tecniche analitiche hanno rese possibile misurare perfino le
piccolissime quantità di argon-40, l’isotopo stabile del suo decadimento, che sono
presenti in rocce aventi un’età di solo 50.000 anni |
Per datare eventi ancora più recenti ci si basa sul carbonio-14 (detto anche radiocarbonio),
un isotopo radioattivo del carbonio, che ha un tempo di dimezzamento di appena 5730 anni e
viene molto usato per datare avvenimenti della storia dell’uomo. Fino alla fine degli
anni ’70 lo si poteva utilizzare solo per datare eventi compresi entro gli ultimi
40.000-50.000 anni; tuttavia, l’introduzione, anche in questo caso, di tecniche
analitiche più sofisticate ha esteso il campo di impiego di questo "orologio":
in alcuni casi si può arrivare fino a eventi di 75000 anni fa. Si tratta di un importante
passo avanti, perché, a questo punto, i geologi possono datare – per esempio –
molti fenomeni dell’Epoca Glaciale che per prima non potevano essere datati con
precisione.
| Elemento progenitore |
Tempo di dimezzamento
(in anni) |
Elemento figlio |
Materiali datati |
| Carbonio-14 |
5730 |
Azoto-14 |
Materiali organici |
| Uranio-235 |
723 milioni |
Piombo-207 |
Zircone, Uraninite, Pechblenda |
| Potassio-40 |
1.300 milioni |
Argon-40 |
Muscovite, Biotite, Orneblenda, Feldspato
potassico
Rocce vulcaniche |
| Uranio-238 |
4.510 milioni |
Piombo-206 |
Zircone, Uraninite, Pechblenda |
| Torio-232 |
13.900 milioni |
Piombo-208 |
Rocce vulcaniche |
| Rubidio-87 |
47.000 milioni |
Stronzio-87 |
Miche, Feldispati potassici
Rocce metamorfiche |
Prendiamo in esame per esempio il caso dell’uranio-238. È
stato dimostrato che l'uranio-238 (238U) ha la caratteristica di emettere
radiazioni a velocità costante senza essere influenzato da fattori ambientali, trasformandosi,
dopo un tempo ben determinato, in piombo (206Pb).
L'uranio è stato presente, fin dai tempi della formazione della terra e in maggiore
quantità rispetto a oggi, in alcuni minerali della crosta terrestre. Valutando le
quantità relative di piombo e di uranio radioattivo presente nelle rocce si è
potuto stabilire che esse sono tanto più antiche quanto maggiore è il loro
contenuto in piombo e minore quello di uranio radioattivo.
Per esempio se in una roccia sono presenti inizialmente 100 milligrammi di 238U,
questi generano per trasformazione radioattiva 10 milligrammi di 206Pb in 680
milioni di anni, venti milligrammi in 1,45 miliardi di anni,
50 milligrammi in 4,5 miliardi di anni, che è il tempo di
dimezzamento dell'uranio-238, cioè il tempo necessario perché si trasformi in
piombo il 50% per cento dell'uranio inizialmente presente. Conoscendo il tempo di
dimezzamento dell'uranio-238, l'età della roccia può essere agevolmente calcolata
determinando il rapporto tra quantità di 238U inizialmente presente e la
quantità di 206Pb prodotto.
Possiamo paragonare tutto ciò a una clessidra: se noi sappiamo quanto tempo
impiega la sabbia a scendere nel comparto inferiore della clessidra, il rapporto tra
quantità di sabbia presente nell'uno e nell'altro dei due comparti ci permette di
calcolare il tempo trascorso da quando la sabbia ha cominciato a scendere.

Fig. 2
Formazione(A) e decadimento(B) del
carbonio-14. |
Un altro importante decadimento da prendere in considerazione è quello del
carbonio-14 (14C). Questo elemento viene continuamente prodotto nell’alta
atmosfera ad opera dei raggi cosmici (particelle a elevata energia provenienti dallo
spazio esterno), i quali, colpendo i nuclei dei gas ivi presenti, li spezzano. I neutroni
che così si liberano vengono assorbiti dai nuclei del comune isotopo dell’azoto
(numero atomico 7, numero di massa 14), dove causano l’emissione di un protone: di
conseguenza, il numero atomico diminuisce di 1 unità (passa cioè da 7 a 6) e si origina
appunto il carbonio-14 radioattivo. [ fig. 2A]
|
Il carbonio-14 si lega immediatamente con l’ossigeno formando anidride carbonica,
e, sotto forma di questo suo composto, viene incorporate dalle piante (e, attraverso
queste, dagli animali) assieme al carbonio-12, l’altro isotopo, molto più abbondante
e non radioattivo, del carbonio. Il risultato è che tutti gli esseri viventi contengono
una piccola percentuale di carbonio-14, che però, essendo instabile, tende a decadere,
con emissione di una particella b , ritrasformandosi in azoto-14 [fig. 2B]
| Finché un organismo vive, il radiocarbonio che decade viene rimpiazzato
da altro radiocarbonio, e quindi rimane costante in quell’organismo il rapporto tra
carbonio-14 e carbonio-12. Ma, non appena l’organismo muore, la quantità di
carbonio-14, non più rimpiazzato, comincia a diminuire, mentre resta costante quella di
carbonio-12. Quindi, tenendo conto del tempo di dimezzamento
del carbonio-14, si può risalire all’età del campione in esame misurando il
rapporto tra carbonio-14 e carbonio-12. Inoltre sappiamo che il 14C decade
emettendo radiazioni e trasformandosi in azoto (14N). Il suo tempo di
dimezzamento è molto più breve di quello dell'uranio: 5730 anni. Per queste
caratteristiche il carbonio-14 viene usato per dare un età alle ossa o altro materiale
che si è fossilizzato in tempi relativamente recenti. |
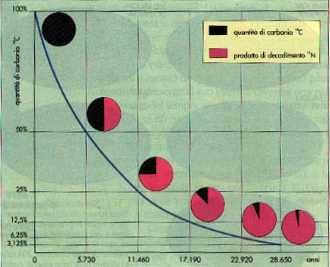
Fig. 3
Grafico dei tempi di decadimento del Carbonio-14. Il metodo
basato sul carbonio radioattivo viene utilizzato per la datazione di rocce e di fossili
fino a 30.000 anni di età. |

Fig. 4
Esempio di una serie di decadimento
radioattivo, quella dell’isotopo più comune dell’uranio (U92238).
Si giunge a un prodotto finale stabile (Pb82206) attraverso numerosi
gradini intermedi costituiti da differenti isotopi. |
Anche se il principio su cui si basa la datazione
radiometrica è relativamente semplice, il procedimento pratico è in realtà molto
complesso, perché la determinazione analitica delle quantità presenti dei due isotopi
(radioattivo e stabile) è molto delicata. La situazione è ulteriormente complicata dal
fatto che in alcuni casi il decadimento dell’isotopo radioattivo non dà direttamente
l’isotopo stabile, come nell’esempio ipotetico di figura 3, ma
avviene attraverso tutta una serie di isotopi radioattivi intermedi, ciascuno con un
proprio tempo di dimezzamento; ad esempio, nel caso dell’uranio-238, si passa
attraverso ben tredici gradini intermedi costituiti da differenti isotopi prima di
arrivare all’isotopo stabile piombo-206 (vedi la figura 4).
I metodi di datazione radiometrica hanno permesso di datare migliaia di eventi della
storia della Terra. |

Pagina iniziale




