Per due secoli, il Sette e l’Ottocento, i chimici andarono lentamente raccogliendo le prove che tutta la materia e’ composta di particelle minutissime, dette atomi, troppo piccole perche’ anche il piu’ potente dei microscopi le potesse rilevare. Osservando la reazione reciproca di varie sostanze, quei chimici riuscirono a determinare con notevole precisione il peso e la grandezza relativa di quelle particelle invisibili, e a rendersi conto in qualche misura dei modi in cui atomi di diversa qualita’ si combinano assieme per formare le svariatissime sostanze che compongono il mondo. Cosi’ gli scienziati del passato giunsero a scoprire taluni elementi, come l’idrogeno, l’ossigeno, il ferro, il rame, e cosi’ via, i quali sono sostanze semplici, ciascuna composta di atomi di un solo tipo particolare; altre sostanze, dette composti, contenevano invece atomi di due o piu’ qualita’, come si vede nella figura(2). L’atomo di un elemento, in sostanza non muta, quando si combina con altri atomi, anche se mutano nettamente le qualita’ accessibili ai nostri sensi. Per esempio gli atomi di ossigeno sotto forma di gas nell’atmosfera sono identici a quelli che, combinandosi con atomi di idrogeno, danno luogo all’acqua. Assai prima che si studiasse la struttura interna degli atomi, gia’ i chimici sapevano molte cose sugli elementi: per esempio che il gas idrogeno era quello che contiene gli atomi piu’ leggeri, e il metallo uranio quello che contiene i piu’ pesanti.

Fig. 2 La varieta' della natura dipende dagli elementi che si combinano fra loro per dar luogo ai composti. Gli elementi sono formati da atomi di un solo tipo. I composti, invecem di molecole che possono contenere atomi di tipi diversi. Questo diagramma illustra i rapporti fra atomi ed elementi e fra molecole e composti. In natura esistono soltanto 92 elementi, ma essi si combinano in modi innumerevoli, a creare il mondo che i nostri sensi percepiscono.
Una vasta serie di esperimenti aveva a poco a poco rivelato la struttura degli atomi. Gran parte del volume atomico e’ occupao dalle orbite degli elettroni in rapido moviemento, ciascuno dei quali porta una unita’ di carica elettrica negativa. L’atomo dell’idrogeno contiene un elettrone soltanto; quello dell’uranio ne contiene 92. Poiche’ gli elettroni sono estremamente leggeri, in pratica tutto il peso dell’atomo si concentra in una minuscola particella centrale di materia, il nucleo. Gli esperimenti chimici rilevarono molte cose anche riguardo al peso degli atomi e al modo in cui essi agiscono l’uno sull’altro mediante gli elettroni della propria estrema periferia. Tutto questo pero’ non diceva nulla, in sostanza, circa il nucleo. Infatti i mutamenti chimici, per esempio la combustione, agiscono soltanto sugli strati piu’ esterni degli elettroni; il nucleo, ben nascosto in mezzo agli elettroni, non subisce mutazione alcuna.
Dal comportamento chimico si puo’ anche dedurre il numero degli elettroni negli atomi di ciascun elemento. Difatti il chimico russo Mendeleiev aveva disposto tutti gli elementi in un preciso ordine chimico, dall’idrogeno all’uranio. Naturalmente Mendeleiev non poteva parlare di elettroni, perche’ gli elettroni non erano ancora stati scoperti; tuttavia la sua disposizione degli elementi corrispondeva al numero di elettroni, che e’ 1 per l’idrogeno, e 92 per l’uranio. In seguito si riusci’ a verificare questo ordinamento chimico per mezzo dei raggi X; nell’interazione fra i raggi X e un atomo si puo’ misurare direttamente il numero degli elettroni. E anche in questo caso restava invariato l’ordine degli elementi: un elettrone per l’idrogeno, due per l’elio, e cosi’ via, fino ai 92 per l’uranio.
Poiche’ di norma gli atomi non hanno carica elettrica, ogni atomo doveva, ovviamente, contenere in qualche modo una quantita’ di elettricita’ positiva che bilanciasse la carica negativa degli elettroni. E inoltre a questa carica positiva doveva imputarsi gran parte del peso dell’atomo, essendo gli elettroni estremamente leggeri. Purtroppo gli esperimenti chimici non riuscivano a mostrare dove, entro l’atomo, fossero carica positiva e massa.
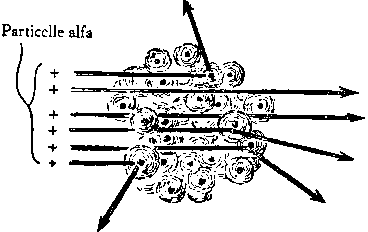
Fig. 3 Lord Rutherford
giunse alla scoperta del nucleo osservando come rimbalzano le
particelle alfa. Fu, il suo, un grande passo avanti
nell'esplorazione della materia. PArve a Rutherford che
l'occasionale ampia deviazione di qualeche particella non
potesse spiegarsi se non supponendo una carica positiva
nell'atomo, concentrata in un minutissimo punto centrale.
Nel 1914 il fisico inglese Ernest Rutherford scopri’ che massa e carica positiva erano concentrate in un punto al centro dell’atomo. Il suo esperimento, che segno’ l’inizio della fisica nucleare, consisteva nello sparare particelle alfa, prodotte dal radio, attraverso sottili lastre di metallo. Di norma le particelle alfa attraversano il sottile foglio metallico sparpagliandosi appena, ma in qualche raro caso subivano una forte deviazione o addirittura rimbalzavano all’indietro, senza trapassare affatto il metallo. Rutherford penso’ che questa fortissima deviazione (fig. 3) non poteva dipendere da altro che da una minuscola particella carica di elettricita’, all’interno dell’atomo. Se l’elettricita’ fosse stata uniforme sarebbe stata impossibile quella forte deviazione delle particelle alfa. Ma immaginando invece la carica situata in un punto preciso, allora era chiaro che una particella alfa poteva ben subire una forte repulsione elettrica, ove per avventura andasse a colpire proprio quel punto esatto. Ed in verita’, relativamente alla grandezza dell’atomo, il nucleo in sostanza e’ un punto, diecimila volte piu’ piccolo dell’atomo stesso: 10-12 centimetro di diametro, rispetto ai 10-8 centimetri di diametro dell’atomo.